GMP dans le secteur pharmaceutique : Comment détecter les défauts – Première partie
Les GMP (Good manufacturing practices ou bonnes pratiques de fabrication) dans le domaine pharmaceutique désignent l’ensemble des règles, procédures et des lignes directrices selon lesquelles la production et l’emballage des médicaments doivent être organisés pour garantir la qualité du produit, la sécurité du patient final et l’intégrité des données critiques. L’activité de validation, que nous réalisons au SPAI, sert à démontrer l’utilisation de processus qui suivent ces critères.
Indépendamment de la méthode analytique utilisée pour effectuer l’analyse et l’évaluation des risques d’un processus dans le secteur pharmaceutique (par exemple, FTA o FMEA), il est nécessaire de bien savoir quels sont les défauts que nous souhaitons éviter et qui peuvent se produire pendant la production et l’emballage des médicaments. Nous les avons regroupés en quatre macro-domaines :
- Défauts concernant les informations critiques sur l’emballage.
- Défauts concernant le médicament.
- Défauts concernant l’emballage.
- Défauts concernant les données variables.
Dans cette première partie de notre voyage à travers les défauts possibles, nous examinons les problèmes qui peuvent survenir dans les informations critiques imprimées sur l’emballage et sur le médicament lui-même.
Défauts concernant les informations critiques sur la confection
Les informations critiques font référence aux données qui sont déjà présentes sur la confection avant qu’elle n’entre dans le processus de conditionnement, par exemple :
- Le nom du médicament.
- Le nom et, le cas échéant, le logo de l’entreprise pharmaceutique.
- Les informations sur le médicament.
- Les posologies.
- La quantité de produit contenue dans la confection.
- Les principaux avertissements (tenir hors de portée des enfants…)
Quels types de défauts peuvent survenir ?
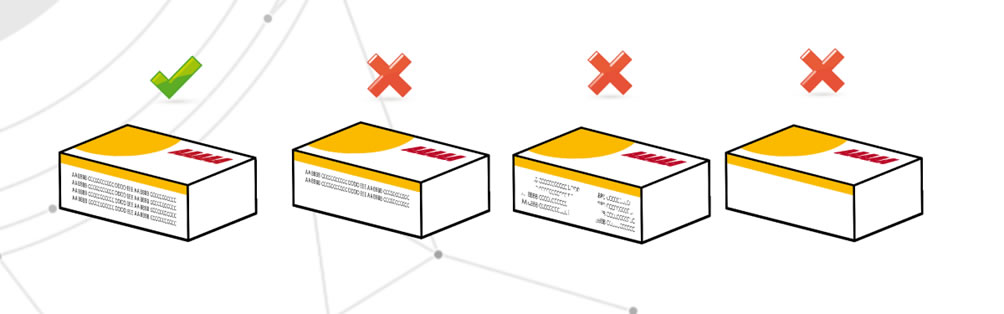
Manque d’informations critiques
Cela signifie l’absence totale ou partielle de ces données, mais aussi leur illisibilité. Les problèmes peuvent, par exemple, provenir de procédés d’impression typographiques. Le risque est que le patient ne reçoive pas une information complète.
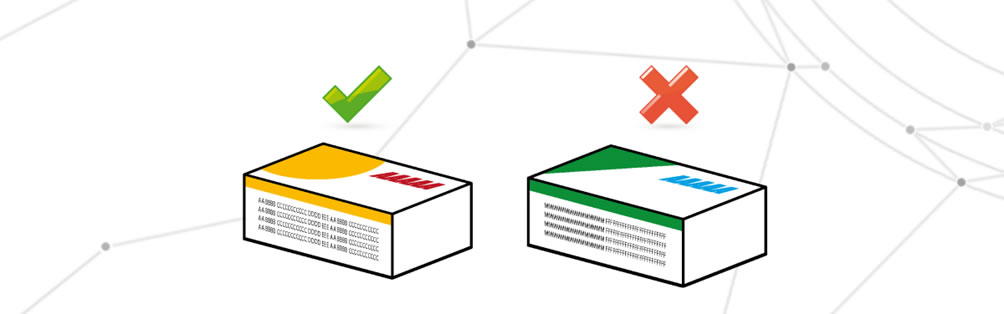
Des informations critiques qui ne correspondent pas à ce qui est attendu
Dans ce cas, toutes les informations requises figurent sur la confection, mais la correspondance avec le médicament interne ou l’exactitude des informations est incorrecte. Il est possible que des données obsolètes soient utilisées ou que la mauvaise confection soit utilisée. La cause de ce défaut est généralement du à un mélange d’emballages ou à une mauvaise gestion du stockage.
Défauts concernant le médicament
Dans ce cas, nous faisons référence au médicament lui-même. Les défauts peuvent être causés par divers facteurs dans la phase de production et d’emballage, entrainant divers problèmes. Ces défauts peuvent conduire à l’inefficacité du traitement ou, dans le pire des cas, à des effets secondaires graves.
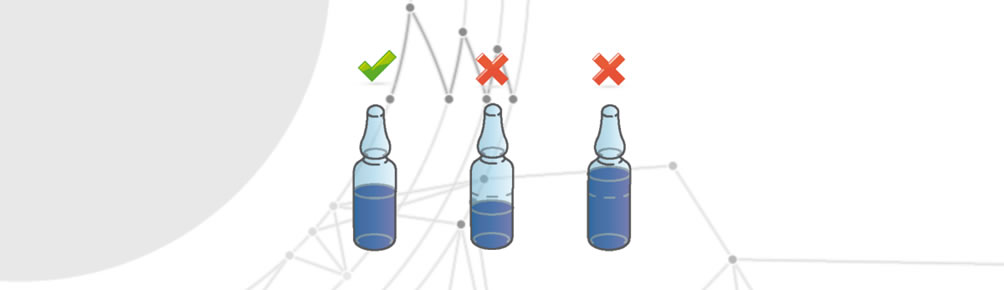
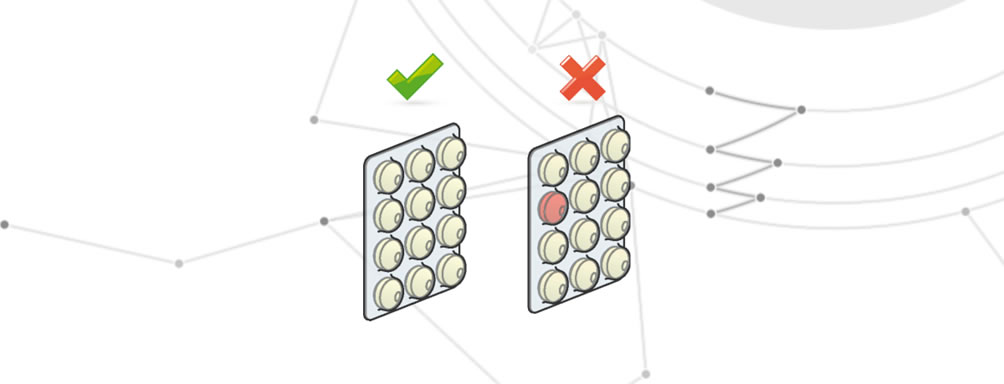
Une quantité incorrecte du médicament
Se produit lorsqu’un emballage à usage unique contient une quantité de médicament en excès ou en deçà des conditions établies.
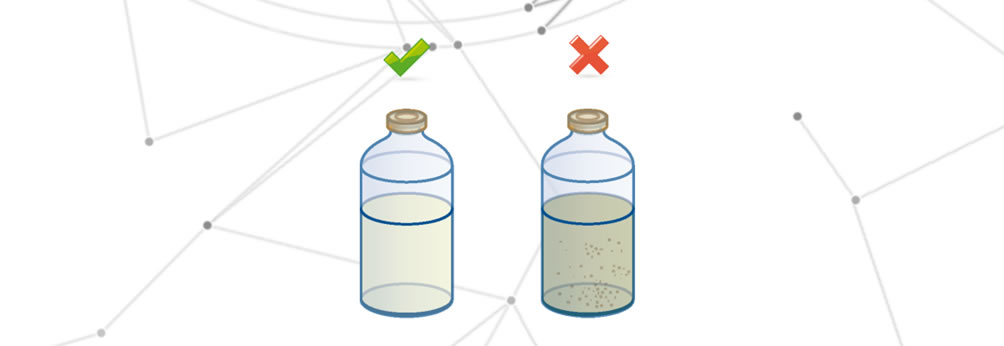
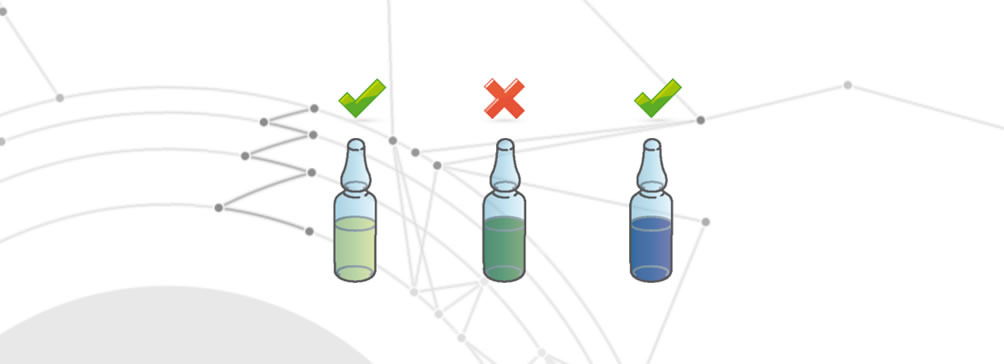
Dégradation du médicament
La dégradation du médicament se produit lorsque l’un des changements suivants se produit :
- Modification des propriétés organoleptiques.
- Réduction totale ou partielle de l’effet thérapeutique.
- Effets altérés sur le patient final.
Contamination croisée
Un défaut de contamination croisée se produit lorsque le médicament contient des substances actives différentes de celles qu’il est censé contenir. Ces différentes substances actives dépassent les tolérances d’acceptabilité prévues par la loi. Ce défaut peut résulter, par exemple, d’un mauvais nettoyage de la chaîne de production entre un médicament et un autre, ou de la présence d’agents extérieurs.
Produit incorrect
Par produit incorrect, on entend l’utilisation d’un produit qui n’est pas couvert par le lot de production.
GMP dans le secteur pharmaceutique : Comment détecter les défauts – Deuxième partie
Photo par Anna Shvets sur Pexels




