GMP im pharmazeutischen Sektor: Wie man Fehler erkennt – Teil 1
GMP (Good Manufacturing Practices) bezeichnet im pharmazeutischen Sektor eine Reihe von Regeln, Verfahren und Richtlinien, nach denen die Herstellung und Verpackung von Arzneimitteln organisiert werden muss, um die Produktqualität, die Sicherheit des Endpatienten und die Integrität wichtiger Daten zu garantieren. Die Validierungstätigkeit, die wir bei SPAI durchführen, dient dem Nachweis der Anwendung von Verfahren, die diesen Kriterien entsprechen
Unabhängig von der Analysemethode, die zur Durchführung der Analyse und Risikobewertung eines Prozesses im pharmazeutischen Sektor verwendet wird (z. B. FTA oder FMEA), ist es notwendig, ein klares Verständnis der Fehler zu haben, die wir vermeiden wollen und die bei der Herstellung und Verpackung von Medikamenten auftreten können. Wir haben sie in vier Makrobereiche eingeteilt:
- Mängel in Bezug auf kritische Informationen auf der Verpackung.
- Mängel des Arzneimittels.
- Mängel an der Verpackung.
- Mängel in Bezug auf variablen Daten.
In diesem ersten Teil unseres Streifzugs durch die möglichen Fehler betrachten wir, welche Probleme bei den kritischen Informationen auf der Verpackung und im Arzneimittel selbst auftreten können.
Mängel in Bezug auf kritische Informationen auf der Verpackung
Kritische Informationen beziehen sich auf Daten, die bereits auf der Verpackung vorhanden sind, bevor sie zum Beispiel in den Verpackungsprozess geht:
- Der Name des Medikaments.
- Der Name und das Logo des Pharmaunternehmens.
- Informationen über das Medikament.
- Die Dosierung.
- Die Menge des Produkts in der Packung.
- Die wichtigsten Warnhinweise (für Kinder unerreichbar aufbewahren…)
Welche Arten von Mängeln können auftreten?
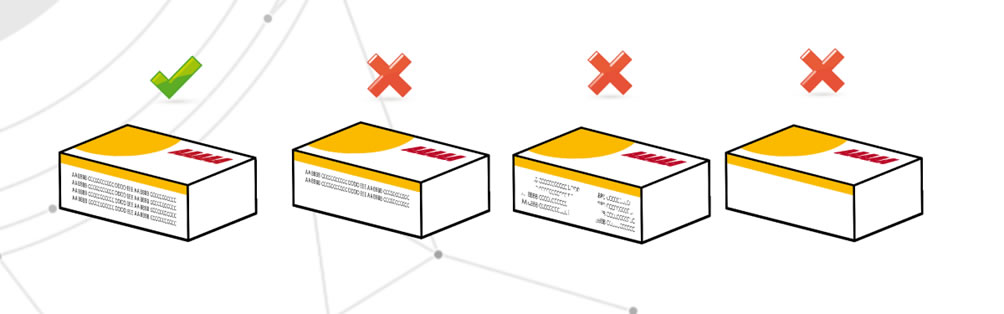
Mangel an kritischen Informationen
Dies bedeutet das völlige oder teilweise Fehlen solcher Daten, aber auch die Unlesbarkeit solcher Daten. Probleme können z. B. durch typografische Druckverfahren entstehen. Das Risiko besteht darin, dass der Patient nicht vollständig informiert wird.
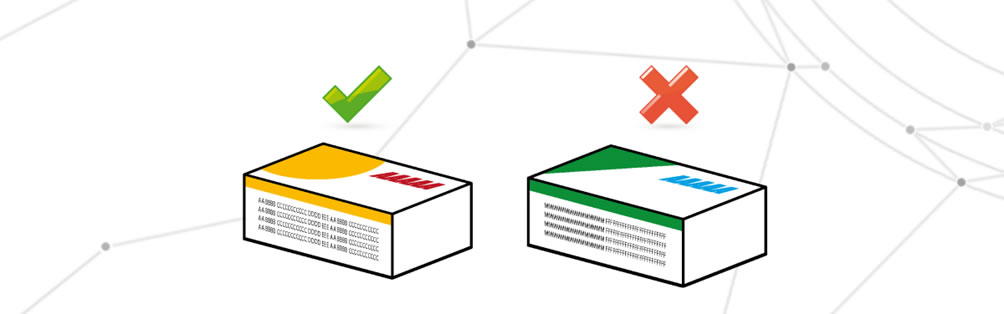
Kritische und nicht übereinstimmende Informationen
In diesem Fall finden wir alle erforderlichen Informationen auf der Verpackung, aber die Übereinstimmung mit der inneren Medizin oder die Richtigkeit derselben Informationen ist nicht korrekt. Es kann vorkommen, dass veraltete Daten oder falsche Verpackungen verwendet werden. Die Ursache für diesen Fehler ist in der Regel die Umschichtung von Verpackungen oder eine falsche Verwaltung der Bestände.
Mängel des Arzneimittels
In diesem Fall handelt es sich um das eigentliche Arzneimittel. Mängel können durch eine Vielzahl von Faktoren in der Produktions- und Verpackungsphase verursacht werden und zu verschiedenen Problemen führen. Diese Mängel können zur Unwirksamkeit der Therapie oder im schlimmsten Fall zu schweren Nebenwirkungen führen.
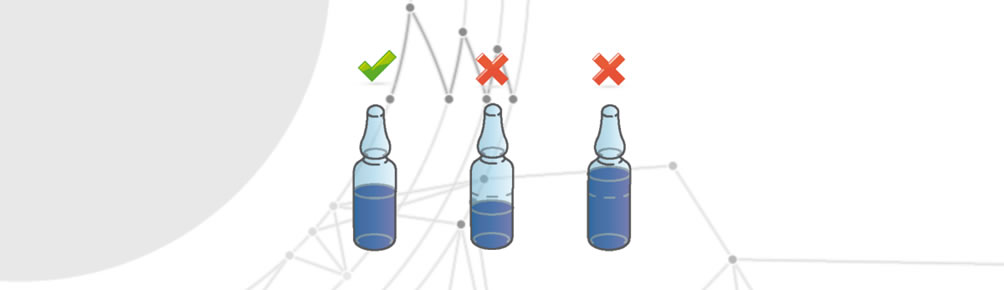
Falsche Menge des Medikaments
Tritt auf, wenn eine Einwegpackung mehr oder weniger als die vorgeschriebene Menge an Medikamenten enthält.
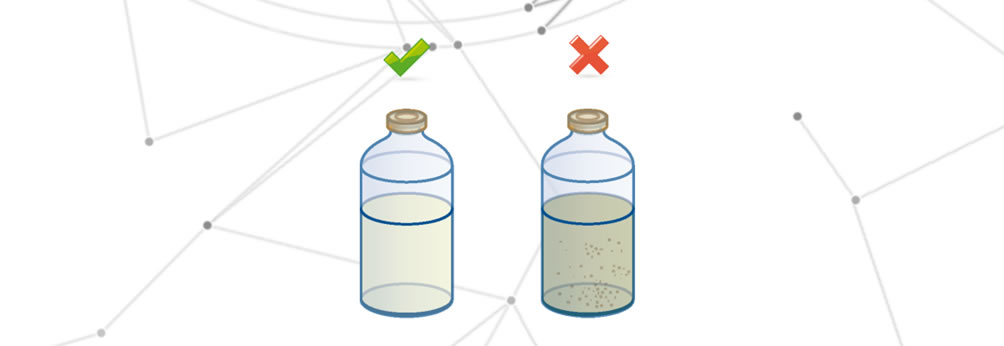
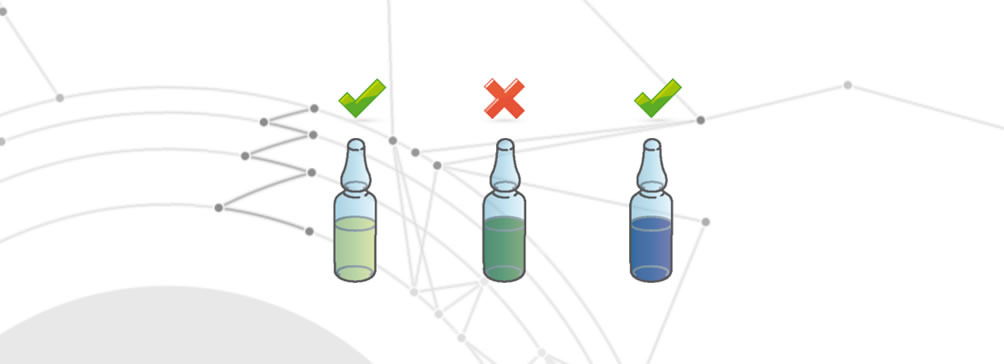
Medikamentenabbau
Der Abbau des Arzneimittels erfolgt, wenn eine der folgenden Veränderungen eintritt:
- Veränderung der organoleptischen Eigenschaften.
- Vollständige oder teilweise Verringerung der therapeutischen Wirkung.
- Veränderung der Auswirkungen auf den Endpatienten.
Kreuzkontamination
Der Fehler der Kreuzkontamination tritt auf, wenn das Arzneimittel andere Wirkstoffe enthält, als es eigentlich sollte. Diese verschiedenen Wirkstoffe überschreiten die gesetzlich vorgeschriebenen Toleranzen für die Zulässigkeit. Dieser Fehler kann z. B. durch eine fehlerhafte Reinigung der Produktionslinie zwischen den einzelnen Arzneimitteln oder durch das Vorhandensein von Fremdstoffen entstehen.
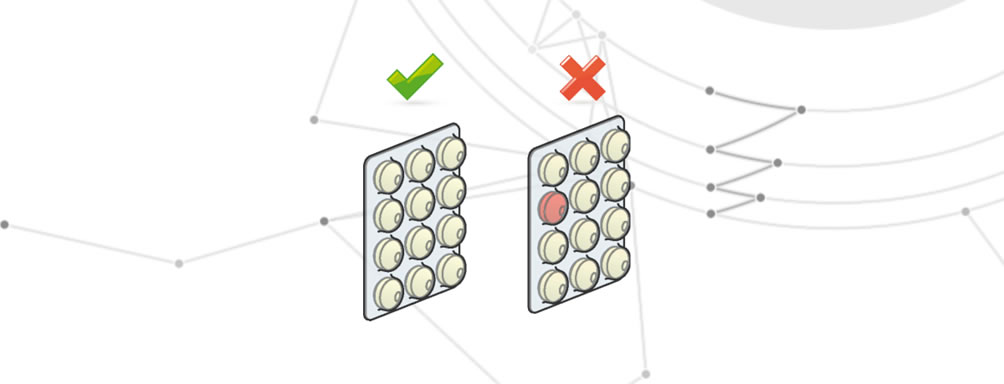
Falsches Produkt
Falsches Produkt bedeutet die Verwendung eines Produkts, das nicht in der Produktionscharge enthalten ist.
GMP im pharmazeutischen Sektor: Wie man Fehler erkennt – Teil 2
Photo by Anna Shvets on Pexels




