GMP dans le secteur pharmaceutique : Comment détecter les défauts – Deuxième partie
Dans la première partie de notre voyage à travers les défauts potentiels qui peuvent survenir dans la production et l’emballage des médicaments, nous nous sommes concentrés sur les données critiques imprimées sur l’emballage et les défauts du médicament lui-même. Aujourd’hui, nous abordons les deux autres macro-domaines de défauts potentiels : ceux concernant l’emballage et ceux concernant les données variables.
Défauts d’emballage
Par emballage, on entend l’ensemble des enveloppes de protection destinées à protéger le médicament et à en assurer le transport.
Emballage incomplet
Un emballage incomplet est défini comme un emballage auquel il manque totalement ou partiellement une de ses parties. Par exemple, une confection qui devrait contenir dix sachets de médicaments mais qui n’en contient que huit. Dans ce cas, l’emballage est incomplet et le patient risque de ne pas être en mesure de suivre le traitement prescrit.
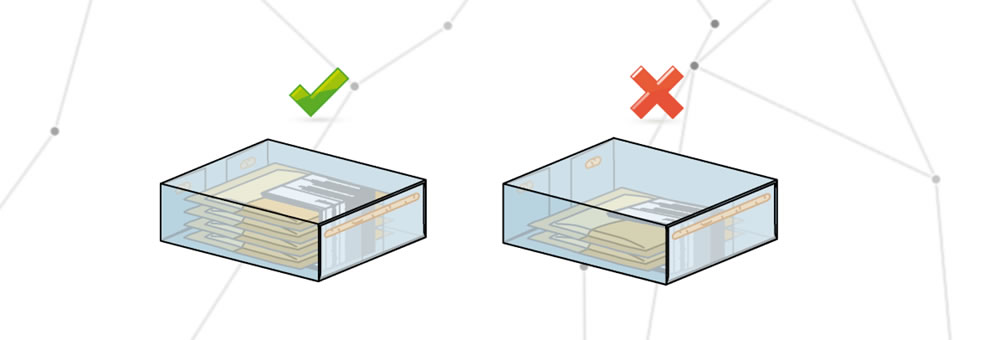
Un emballage incorrect
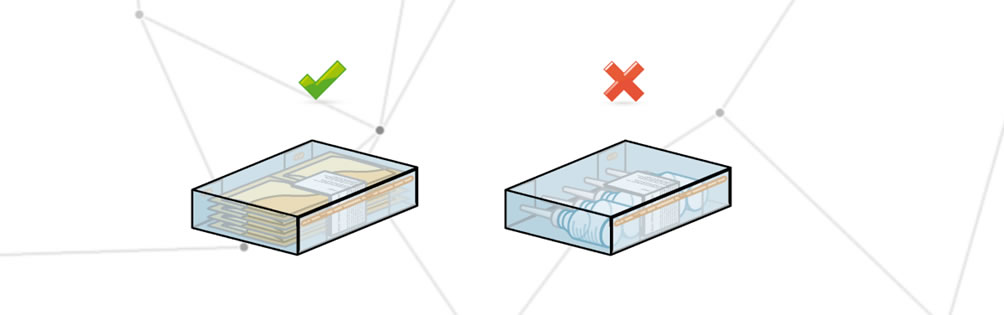
Un emballage incorrect contient un ou plusieurs éléments qui ne sont pas inclus dans le rapport d’emballage.
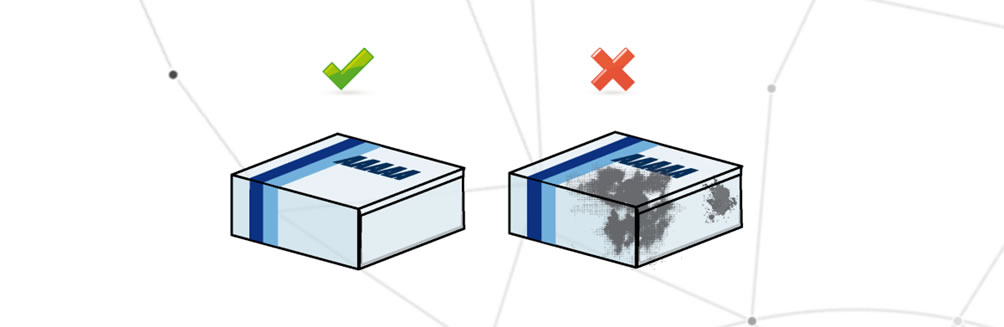
Emballage sale
L’emballage est défini comme sale lorsqu’il comporte des parties étrangères susceptibles de modifier son apparence ou de rendre illisibles les informations figurant sur l’emballage.
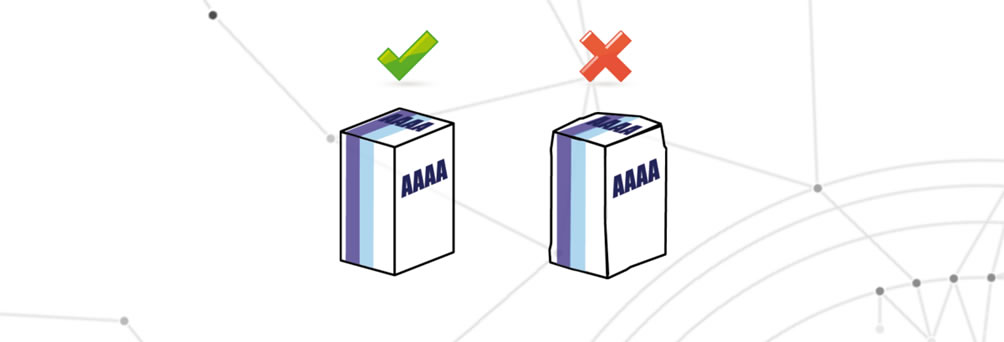
Emballage endommagé
L’emballage est endommagé lorsqu’un ou plusieurs éléments de l’emballage présentent un dégât esthétique.
Défauts concernant les données variables
Les données variables sont imprimées sur la confection pendant l’emballage du médicament ou stockées sur les systèmes à valider. Il s’agit d’informations importantes telles que la date de péremption, le numéro de lot et d’autres paramètres.
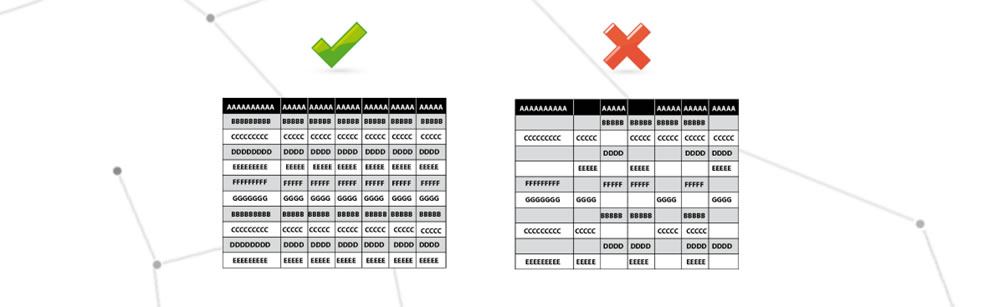
Illegibilité des données variables
L’illisibilité des données variables signifie : absence totale, présence partielle, impression peu claire.
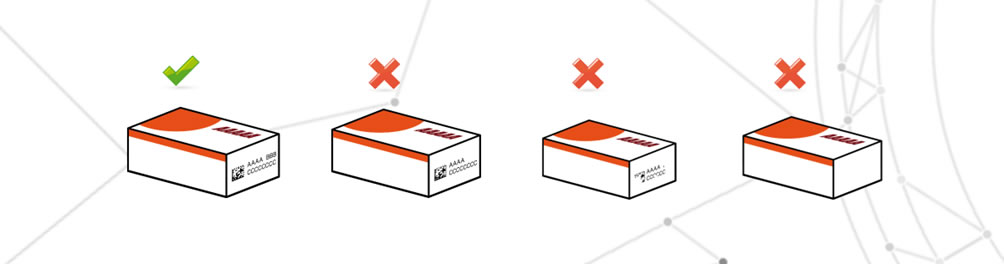
Données variables incorrectes
Les données variables incorrectes sont définies comme l’impression d’informations erronée à celle prévue dans le rapport d’emballage.
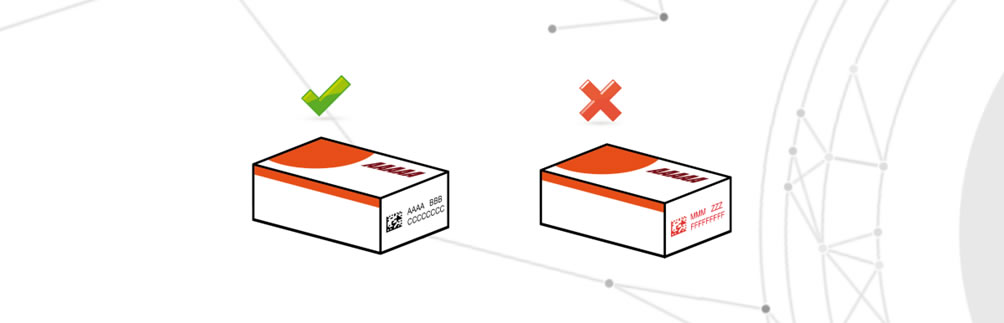
Perte d’informations critiques sur les GMP
Les informations critiques relatives aux GMP font référence aux informations stockées sur les systèmes à valider qui contiennent des paramètres critiques, par exemple la sérialisation du médicament, l’enregistrement des paramètres critiques, les changements de processus.
GMP dans le secteur pharmaceutique : Comment détecter les défauts – Première partie
Photo par Karolina Grabowska sur Pexels




